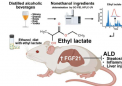
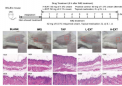
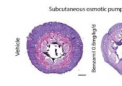
键能的定义及其重要性
键能是化学中一个重要的概念,它描述了在标准条件下将一摩尔共价键完全断裂所需的能量。简单来说,键能反映了分子内部化学键的强度。例如,氢气(H₂)分子中的氢-氢键具有一定的键能,当这个键被断裂时,需要吸收一定量的能量。
键能的单位通常为千焦每摩尔(kJ/mol)。一般来说,键能越大,化学键越牢固,分子越稳定;反之,则说明化学键较弱,分子容易发生反应。例如,碳-碳单键的键能约为348 kJ/mol,而碳-碳双键的键能则接近612 kJ/mol,这表明双键比单键更难以断裂,因此更加稳定。
键能在化学研究和实际应用中具有重要意义。首先,在有机化学反应机理的研究中,键能帮助科学家理解哪些化学键更容易断裂或形成,从而预测反应的方向和速率。其次,在工业生产中,许多催化过程依赖于对特定化学键的理解与操控,通过调整条件来优化键能的变化,提高产率并降低能耗。此外,键能还与材料科学密切相关,如高分子材料的设计需要考虑聚合物链间作用力的强弱,而这直接取决于化学键的稳定性。
总之,键能不仅是衡量化学键强度的重要参数,也是连接理论化学与实践应用的关键桥梁。深入理解键能的本质有助于推动科学技术的发展,并为解决能源、环境等问题提供新的思路。
 新传媒网
新传媒网